�z�[�� > �{�Y > �{�Y�̏�� > �����E�����i�̐��Y�H���ɂ�����A1�����A2�~���N�̕i������Ɋւ��钲������
���R��w��w�@�@���������R�Ȋw�����ȁ@�����@����@����
�y�v��z
�@���Q������s���Ă��鐶�Y��2���i�_��T����чU�j�̃z���X�^�C����v141����ΏۂƂ��āA�Q�m�~�b�N�]���Ɋ�Â�A2���̃x�l�t�B�b�g�E���X�N�]�����s�����B�_��T�ɂ�����CSN2��`�q�^�p�x�́AA1A1��0.19�AA1A2��0.49�AA2A2��0.32�ł���A�_��U�ł͂��ꂼ��0.10�A0.49�����0.41�ł������B�N�����t�@�C�h�E�v���X�Ő��Y���A�ɐB���A�̌^�A�����A���a�������X�N�Ȃǂׂ��Ƃ���AA2A2�^�̕���305������ł̎��b�ʁA�^���p�N���ʁA�����b���A���^���p�N�����Ȃǂ��܂��܂ȓ_�ŗD���ƕ]�����ꂽ�B305������ł̓��ʁA���Y�����ɗL�Ӎ��͂Ȃ��AA2���̓x�l�t�B�b�g���傫���Ɣ��f����邪�A�����D�P���A�o�Y����ٗ����Ⴍ�A��l�ݕψʂ̃��X�N�������Ƃ����m���́A�Q�m�~�b�N�]�����g�債�Đ��x�����߂�K�v������B
�@�����āA�~���N����у��[�O���g����J�[�C�������A�������y�f��������ь��O��߂��ăy�v�`�h��BCM�|7�𑪒肵���BA1�~���N���炾���łȂ�A2�~���N�����BCM�|7�����ʐ������ADPP4������L������_�ۂŃ��[�O���g���쐬�����BCM�|7�����ʂ͔����ȉ��ƂȂ����B
1�@�͂��߂�
�i1�jA2�~���N�̊T��
�@A1�^��β�|�J�[�C�����ݒ��̉^�����≊�ǂɉe������Ȃǂ̕��āA������܂܂Ȃ�A2�~���N�������̔������悤�ɂȂ����B�擱�����̂�2000�N�ɐݗ����ꂽ�j���[�W�[�����h��A2�R�[�|���[�V�����i��A2�~���N�J���p�j�[�j�ŁA���c���ˑR���nj�Q�A���������S�����A�T�^���A�a�A���ǂƂ����������̎�����A1�~���N�̐ێ悪�֗^����Ƃ����咣���Ȃ��ꂽ�B���N�e���ɂ��Ă͓�������٘_�A���_������A�Ȋw�I���r���[���s�������B�H�i���S�@�ւ́AA2�~���N�̗D�ʐ������������͏\���łȂ��Ƙ_���Ă���iEFSA�@Science Report 2009�j�B���{�̐H�i���S�ψ�������̌���1�j���x�����Ă��邪�A2018�N�ɂ���܂ʼn��^�I�������l�X����t�H���e���Ƃ��������ƃ��[�J�[���Q�����A���E��A2�~���N�s��͈�C�Ɋ����������B22�N�̎s���1��3000���~�K�͂Ɛ�������Ă���A29�N�ɂ�3��5000���~�K�͂ɂȂ�Ɨ\������Ă���B���{�ł͈ꕔ�̏���҂�A2�~���N��m���Ă���Ƃ������x�ł��邪�A�A�W�A�A���ɒ����ł́@�@A2�~���N�ɋ�������эw���ӗ~����������҂������X��2�j�ɂ���BA2�~���N�́Aβ�|�J�[�C�������肾��CSN2��`�q�i��1�j��A2A2�̋����W�߁A���̐����ꃍ�b�g�ŎE�ہE�[�U ����̐��������邱�Ƃ��ł���B
�@A2�~���N��F�߂邱�Ƃ́A���ʂ̃~���N�iA1�~���N�j�ɑ������҂̉��l�ςɉe�����y�ڂ��\��������B�N�[���[�X�e�[�V������������Y���ʑ̐����嗬�Ƃ������Ƃ�����A���{�ł͂���܂�A2�~���N�Ɋւ��錤�������ɒᒲ�ł������B����A���Y�҂̒��ɂ�A2�~���N�Ɋ��H�����o�����Ƃ���҂�����A2018�N12���ɃX�^�[�g����JA���W�Â���ɁA����10�c�̂����K�͂�BtoC�}�[�P�e�B���O���s���Ă���BA1�~���N���������Ă͂����Ȃ��̂ŁA�������b�g������������A2���Ɏ��g�݂₷���B2020�N�ɂ�A2�~���N�Ɋւ���������̏�Ƃ��āA��ʎВc�@�lA2�~���N����ݗ�����Ă���B
�i��1�j���^���p�N���̖�80���̓J�[�C���ŁA��20�����z�G�C�^���p�N������Ȃ�B�J�[�C���͂����αs1-�J�[�C���Aαs2-�J�[�C���Aβ-�J�[�C���Aκ-�J�[�C����4�O���[�v�ɕ������A���������o����`�q��CSN1S1�ACSN1S2�ACSN2�����CSN3��`�q�ł���Bβ-�J�[�C���͋������J�[�C����30�`35�����߂�B
�i2�j����܂ł̒��������̌o��
�@�M�҂�́A���R���f�R �n��̃W���[�W�[���ΏۂƂ������{�A�q���A�����Ǘ��Ɋւ�钲���������s���Ă����B�f�R���_�_�Ƌ����g���i�ȉ��u�f���v�Ƃ����B�j���̗v�]�ɉ����Ďn�߂��������^�����ł���B���n���A2���̋@�^�����܂����̂�2018�N����ŁA������ĕM�҂�͕f���g���������炷��W���[�W�[��590����CSN2��`�q�f�f���s�����B���R���i�^��ƒ{�ی��q�����A�_�ѐ��Y�����Z���^�[�{�Y�������j�A�����l�����_��w�Z�A�f���g�����̋��͂Ŏ��{�ł������Ԓ����ł���B�W���[�W�[���A2����i�߂��b������邱�Ƃ��ł������A���̒����������s�����ŁAA2�~���N�Ɋւ��錤���͖������A���𖾂̉ۑ肪���Ȃ��Ȃ����ƂɋC�t�����B�����ǂɐ��݂��郊�X�N�A�i���Ǘ��A�i���ۏ̕��@�ȂǁA���P�\�ȕ���������B�����ۑ�@��������i�������@�̊J���Ƃ����A����Ȃ�L���肪���҂ł���ۑ肪���邱�Ƃ����������B��啪������f���钲���������K�v�ƍl���A�M�҂��22�N10���̊��{�Y�w��R���ɂ����āA�uA2�~���N���ĉ��H�v�Ƃ����e�[�}�Ō��J�V���|�W�E�����J�Â����B���̃V���|�W�E�������������ɁA���_����ѐH�i�Y�ƊW�҂ƈӌ���������@��������B
�i3�j�{�e�ɂ����钲���ړI
�@���{�̓�����99���ȏオ�z���X�^�C����ł���A�{�e�ł̓z���X�^�C���킨��т��̃~���N��ΏۂƂ��ĕi���Ǘ�����ѕi������Ɋւ��钲�����s�����B�z���X�^�C�����A1A1�����A1A2�̋������킹��60�`70���Ƒ����B�����ǂ����ƁA���_���Ƃ̎������A�����i�̕i���Ȃǂɑ傫���e������B����A�z���X�^�C����ŎЉ�����ɂȂ���Z�p�J�����ł���AA2�s��͌㔭�Ȃ���A�t�����l�̍������{�u�����h��H�i�Y�Ƃɉ����邱�Ƃ��ł��邩������Ȃ��B�����́A���p�������ŏ����Ă���̂ł͂Ȃ��A�َq�E�f�U�[�g�A�A�C�X�N���[���ȂǁA���H�ɂ���Ă��܂��܂Ȍ`�ԁA���A�H���ɕω����ď����Ă���B�����āA���_�ۂ𗘗p�����@�\���C���̉\���ɂ��Ă��������邱�ƂƂ����B
2�@A2���̃x�l�t�B�b�g�E���X�N�]��
�i1�jA2���ƈ�����
�@�q�g�A���M�A�q�c�W�A�u�^�ȂǁA�E�V�ȊO�̓�����CSN2��`�q�^�����ׂ�A2A2�ŁAA1�~���N�̓E�V�������Y�ݏo���B�ƒ{���O�̓E�V��A2A2�������ƍl�����Ă���AA1�Ƃ����ψق͉��ǂ��i�z���X�^�C����ő����݂���i�}1�j�B���Ȃ킿�AA2���͂���܂ł̈����ǂ��t�s������\�����[���ł͂Ȃ��BA2A2���́AA1A1�����A1A2�������������Ⴂ�Ƃ���������B�����͈��v�悩����ۂɐ�����܂ł��悻3�N�̌�����v���邽�߁A��������ׂĂ�A2A2���Ƃ���A2���́A5�`10�N������̎��Ƃł���B�����ǂ����ł���A������C������̂ɂ����l�̎��Ԃ�������B

�i2�j�]����@
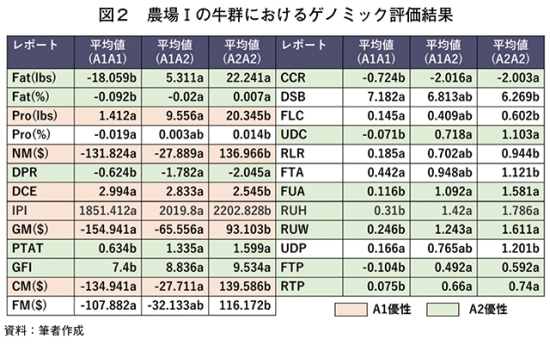
�@���݂�A2���́ACSN2��`�q�̕\���^�iA2A2�j�����Ői�߂��Ă��邪�ASNP����i��2�j�Ɋ�Â��Q�m�~�b�N�]����g�ݍ��킹��A����A�ɐB�A�Ǘ��A�̌^�Ȃǂ̌`�����܂߂���`����^�̈����ǂ��\�ƂȂ�B�܂��A���Q��������{���Ă���2���i�_��T����чU�j�̐��Y�҂�ΏۂƂ��āA���v141���i�_��T����чU���炻�ꂼ��91�����50���j�̃Q�m�~�b�N�]�����s�����B�э����邢�͎��Ђ��̎悵�ă]�G�e�B�X�E�W���p��������Ёi�{�Г����s�a�J��j�̌������{�ɑ���A�N�����t�@�C�h�E�v���X�i���Ђ̒���Q�m�������T�[�r�X�j�Ő��Y���A�ɐB���A�̌^�A�����A���a�������X�N�Ȃǂ�]�������B��ʎВc�@�l�ƒ{���ǎ��ƒc�ł������̃Q�m�~�b�N�]���͍s���Ă��邪�A�{�����̎��{���ɂ�CSN2��`�q��SNP�]���͒������ڂɊ܂܂�Ă��Ȃ������B�Ȃ��A�ƒ{���ǎ��ƒc��2024�N1������β�|�J�[�C���̈�`�q�������J�n���Ă���B
�i��2�j���鐶����W�c�̃Q�m������z�ŁA�ꉖ��ψق��Ă��邱�ƁB���̑SDNA�̒���400���J���ȏ㑶�݂��Ă���Ƃ���Ă���A���̑��^�ɂ���āA���܂��܂Ȍ̍���������Ƃ����Ă���B
�i3�jCSN2��`�q�^�p�x
�@�_��T�ɂ�����CSN2��`�q�^�p�x�i��3�j�́AA1A1��0.19�AA1A2��0.49�AA2A2��0.32�ł���AA1�����A2��`�q�p�x�͂��ꂼ��0.43�����0.57�ł������B�_��U�ł�A1A1��0.10�AA1A2��0.49�AA2A2��0.41�ł���AA1�����A2��`�q�p�x�͂��ꂼ��0.35�����0.65�ł������B�������������W�c�͂������CSN2��`�q�ɂ��đI���͍s���Ă��Ȃ��Ɣ��f�ł����B�_��T�̋��Q�ł́AA1A1�^�̕��������D�P���A�o�Y����ٗ��A�ߌ��W���ɂ����ėD������AA2A2�^�̕���305������ł̎��b�ʁA�^���p�N���ʁA�����b���A���^���p�N�����A���U���v�A�`�[�Y�K���A�����K���A���q�K���A�A�C�W�F�j�e�B�\�͎w���i��4�j�A�������ؓ�x�A�������Y���A�̌^�A���퍬���w���A���������w���A�������_���D��Ă���ƕ]�����ꂽ�i�}2�j�B305������ł̓��ʁA���Y�����ɗL�Ӎ��͂Ȃ������B�_��U�̋��Q�ł́A�����̐������Ȃ��������߂��L�Ӎ����݂��鍀�ڂ͂قƂ�ǂȂ��������AA2A2�^�̕�����l�ݕψʂ̃��X�N�������ƕ]�����ꂽ�B�����̌��ʂ́AA2���������ǂ��t�s�����邱�Ƃ͂Ȃ��A���U���v�̌�������҂ł��邱�Ƃ������Ă��邪�AA2A2�^�̕��������D�P���ƌo�Y����ٗ����Ⴍ�A��l�ݕψʂ̃��X�N�������Ƃ����]���͖����ł��Ȃ����O���ڂł��낤�B�����_�ł�141����ΏۂƂ�����͂ɂƂǂ܂��Ă��邽�߁A�Q�m�~�b�N�]�����g�債�Đ��x�����߂�悤�w�߂����B
�i��3�j�����`�q�^�����̂̐����W�c�̑��̐��Ŋ��������́B
�i��4�j�\�͂ɏd�ݕt�����ꂽ�����`���B���������D�܂����B
�i4�j���ʁA�������Ȃǂ̔�r
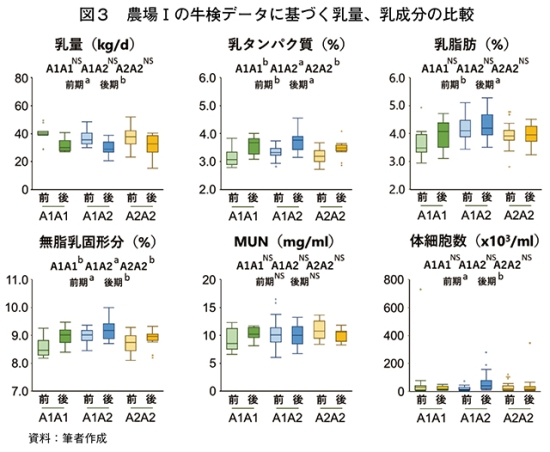
�@�����āA�_��T�̓����f�[�^�Ɋ�Â��āAA1A1���AA1A2���AA2A2���̓��ʁA�������Ȃǂ��r�����B6�J���Ԃ̃f�[�^�ł���A���Ԓ��Ɉ�萔�̓������������邢�͐V���ɍ�����J�n�����ق��A��������A�Ő����A�����A����Ƃ����ڍׂȔ���T�C�N���ŕ]���ł���قǂ̓������m�ۂł��Ȃ������B����ł��A���،�5�J����O���A����ȍ~������Ƃ��邱�ƂŐ}3�̌��ʂ�����ꂽ�B
�@���ʂ͑O���ő����A���^���p�N���A�����b�A�������Ō`���̊���������ō����Ȃ�͈̂�ʓI�����A���^���p�N���Ɩ������Ō`����A1A2���ł��̑��̈�`�q�^�C�v��荂���Ƃ����m���́A��������𑝂₵�Ċm�F����K�v�����낤�B�L�Ӎ��͂Ȃ��������A�{�����ł�A1A2���œ��ʂ����Ȃ��X���ɂ������B���̂��Ƃ�A1A2���̓��������������߂��ƍl�����邪�AA2A2���ɓK�������{�Ǘ��Z�p�Ƃ������̂����邩������Ȃ��B�������ɍ̌����s���Ă���̂ŁA���t����̃f�[�^�ƍ��킹����͂��p�����Ă���B
3�@A1�~���N��A2�~���N�̕i���]���Ƃ��̐���
�i1�jA2�~���N��BCM�|7����
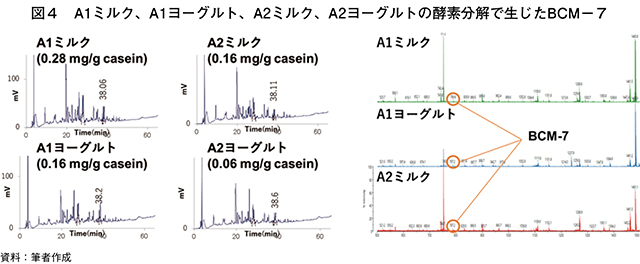
�@A1�^��A2�^��β�|�J�[�C���ɈႢ�������炷�̂́A67�Ԗڂ̃A�~�m�_�iPro67His�j�Ƃ���Ă���BA2�~���N��β�|�J�[�C����Val59�|Tyr60�|Pro61�|Phe62�|Pro63�|Gly64�|Pro65�|Ile66�|Pro67�|Asn68�̃A�~�m�_�z��������AVal59�|Tyr60�̓G���X�^�[�[�i�����y�f�̈�j�ŕ����������̂́AIle66�|Pro67�͂ǂ̏����y�f�ɂ���������Ȃ��BA1�~���N��β�|�J�[�C����Ile66�|His67�ƂȂ��Ă���A���̃y�v�`�h�����������y�f�͕�������B����ɂ��A1�~���N����̂�β�|�J�]�����t�B��7�iBCM�|7�G Tyr60�|Pro61�|Phe62�|Pro63�|Gly64�|Pro65�|Ile66�j��������Ƃ���ABCM�|7�̃I�s�I�C�h�l��p�i�����q�l�̂悤�ȕ�����p�j�Ō��N��Q��������Ƃ����咣���ꕔ�ɂ���B���̂��߁AA2�~���N�ƕ\���������̂́A�d�v�Ȃ̂�A1�t���[���Ȃ킿BCM�|7���Ȃ����Ƃł���B�������A�J�[�C�����y�f��������BCM�|7�����̗L���ׂ�ƁAA2�~���N��������ʂ�BCM�|7���m�F�ł���Ƃ����������BαS1�|�AαS2�|�Aκ�|�J�[�C���Aα�|���N�g�A���u�~���Aβ�|���N�g�O���u������BCM�|7�ɑ�������A�~�m�_�z��͂Ȃ��A���������肾��CSN1S1�ACSN1S2�ACSN3�ALALBA�ALBG��`�q�ɕψق������Ă�BCM�|7�ɑ�������A�~�m�_�z��ɂ͂Ȃ�Ȃ��B�����̐����́A�����ȏ�_����̃o���N�N�[���[�Œቷ�i4�x�j�ۑ������B�W�������ɒቷ���ɒu����邪�A���Ɖ�Ђʼn��M�E�ۂ����܂Œቷ�ۂ̊��������₩�Ƃ͂����p��������B���̊Ԃ�Ile66�|Pro67�̌�������������AA2�~���N����BCM�|7��������悤�ɂȂ�̂�������Ȃ��B���݂̂Ƃ���AA2�~���N�̕i���ۏ͐v�}�iCSN2��`�q�̉���z��j�ōs���Ă���A���i�i�^���p�N���j�ł͂Ȃ���Ă��Ȃ��B
�@�l�ł��ꓮ���ł���A���זE�ɂ�DPP4�iDipeptidyl peptidase IV�j�ƌĂ��v���������ٓI�ȃy�v�`�_�[�[�i�y�v�`�h��������������y�f�̑��́j�����݂���B�v���������ӂ̃y�v�`�h�����͏����y�f�̍�p���ɂ������ADPP4�Ȃǂ̃y�v�`�_�[�[����p���邱�ƂŁA�����̓J�[�C���Ɋ܂܂��A�~�m�_�͂ق�100���i95�����x�j�z���ł���BBCM�|7�̐�������A�uβ�|�J�[�C���͏����z�����������v�Ƃ��������������邱�Ƃ����邪�A�~���N�^���p�N���̉h�{���͋^���Ȃ����ɗD��Ă���B����ADPP4�ɗގ�����y�f���������_�ۂ��܂ޑ����̔������Ɋm�F����邱�Ƃ���A���[�O���g��`�[�Y�̔��y����BCM�|7�O��̂����������\�����w�E����Ă���BA1�~���N�̕s���@���锭�y�@�ƂȂ邩�͕�����Ȃ����A�i���̐�����q�Ƃ��Ē������s�����B
�i2�jBCM�|7�̑�����@
�@�_��T��A1A1�������A2A2������o�P�b�g�~���J�[�ō�����s���A65�x��30���ԎE�ۂ�����������J�[�C�����Ìł������B���S�����Ŏ��b�������A������������������E������BCM�|7�̑���ɋ������B�y�f�����̓J�[�C��24mg/ml�̔Z�x�ōs���A�u�^�y�v�V���ipH2.5�A37�x�A5���ԁj����уE�V�p���N���A�`���ipH7.0�A37�x�A5���ԁj�ɂ���Đ������y�v�`�h���AMWCO�i���敪�q�ʁj10000�����3000��Vivaspin�i���S�Z�k�`���[�u�j�Ō��O��߂��ĕ��q��3000�ȉ��̕�����B������t��HPLC�i�����t�̃N���}�g�O���t�j�ŕ��͂���ƂƂ��ɁAMALDI�|TOF�|MS�i�}�g���b�N�X�x�����[�U�[�E���C�I����s���Ԏ��ʕ��͌v�j��BCM�|7�̗L�����m�F�����B
�i3�jBCM�|7�̑��茋��
�@A1�~���N���炾���łȂ��AA2�~���N�����BCM�|7���������邱�Ƃ��m�F�����i�}4�j�B�����v���Z�X�̉𖾂ɂ��Ă͒������p������K�v�����邪���l�̌��ʂ������͏��Ȃ��Ȃ��B�O�q�̂Ƃ���A�J�[�C���A���N�g�A���u�~���A���N�g�O���u������BCM�|7�ɑ�������A�~�m�_�z��͂Ȃ��AA2�~���N����BCM�|7����������Ƃ������Ƃ́AIle66�|Pro67�̃y�v�`�h�������l�����Ă���قNj��łł͂Ȃ����Ƃ���������B�����y�f�̊���ِ�������قnj����łȂ��A�v���������ӂ̃y�v�`�h�����ɂ���p����Ƃ������Ƃ����邩������Ȃ��B�܂��A�ቷ�ϐ��̔������Q�������ۑ�����DPP4�l�̍y�f����p������\��������B����p�����~���N�́A�T���v�����O�O���[���̐����Ɠ������̐����������������̂ŁA�J�[�C��������܂łɍő��20���Ԓ��x�ቷ�ۑ�����Ă����B
�@BCM�|7��β�|�J�[�C���ɍy�f����p���Đ�������̂ł���A�~���N�����̂܂ܗp���Ă�BCM�|7�𑪒肷�邱�Ƃ͂ł��Ȃ��B�y�v�V���A�g���v�V���A�L���g���v�V���Ƃ����������y�f����p�����Č��o�\�Ȍ`�ɂ���K�v������B�{�����ł̓E�V�p���N���A�`�����g�p�������A�p���N���A�`�����X�� �R���̍y�f�������ŁA�g���v�V���A�L���g���v�V���A�J���{�L�V�y�v�`�_�[�[�̑��ɃA�~���[�[�A���p�[�[�A���{�k�N���A�[�[�Ƃ��������l�ȍy�f���܂ށB���x�ɐ������ꂽ�y�f�ł͂Ȃ��A�X�����邢�͒��ǂɗR������DPP4�����݂��Ă���\��������B�����y�f�����ɗp���鎎��ɖ�肪����Ƃ���ABCM�|7�����̗L������A1�~���N��A2�~���N�����ʂ�����@�͉��ǂ��邢�͏C������Ȃ���Ȃ�Ȃ��B�����ɂ��Ă̌����͎n�߂Ă���A�����ł���悤�m����ςݏd�˂Č��\�������B
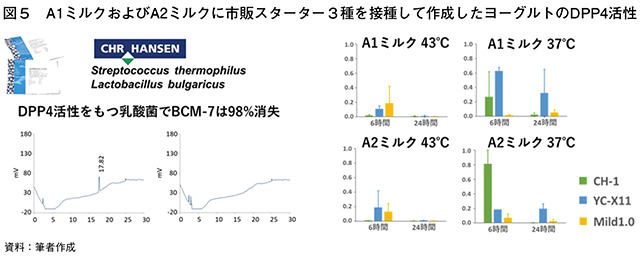
�i4�jDPP4�����̃��j�^�����O
�@DPP4������L������_�ۃX�^�[�^�[��BCM�|7�O��̂y�������邱�Ƃ́A�s�̃X�^�[�^�[3��iCH�|1�AYC�|X11�AMild1.0�j��DPP4���������j�^�����O���邱�ƂŒ��������i�}5�j�BA1A1�^�����A2A2�^�̓�������~���N���̎悵�A65�x��30���ԎE�ۂ��������ɃX�^�[�^�[��ڎ킵��37���邢��43�x��6�����24���Ԕ��y�������BDPP4�����́AGly�|Pro�|pNA����̃j�g���A�j���������ʂ����BCM�|7�̕��𗦂ő��肵���B
�@37�x�Ŕ|�{����ƁA24���Ԍ��pH��CH�|1��3.9�܂Œቺ���Ă���AYC�|X11��Mild1.0�ł�4.3���x�ɂƂǂ܂����B43�x�Ŕ|�{�����ꍇ���A24���Ԍ��pH��CH�|1�ōł��Ⴍ�Ȃ����BDPP4�����̓X�^�[�^�[����є|�{�����ɂ��Ⴂ�����m�ŁACH�|1��YC�|X11��37�x�A6���Ԍ�ɍ��l����������A24���Ԍ�ɂ͊����l���������ቺ�����B�܂��A43�x�ł͔|�{���ԂɊւ�炸DPP4��������l�ł������B���Ȃ킿�A������̃X�^�[�^�[��DPP4�̑ώ_���͒Ⴍ�ABCM�|7�O��̂�����\�͂��������Ƃ��Ă��A���[�O���g�����̏����i�K�ł����͔������邢�͎�������ƍl����ꂽ�B�X�^�[�^�[�ɂ���đώ_����|�{�����ɑ��锽���͈قȂ�̂ŁABCM�|7�O��̂̕������ǂ��܂ō��߂��邩�ɂ��Č����𑱂��Ă���B
4�@�����Ɂ`����̕i������Ɋւ��钲���`
�@A1�~���N�AA2�~���N�̕i������Ƃ����ړI���炷��A�ቷ�ۑ��A�z���W�i�C�Y�A���M�E�ۂƂ����������̐��Y�H����β�J�[�C����Ile66�|Pro67�������Ǝ� �ɂȂ邩�Ȃǂm�ɂ��邱�Ƃ��K�v�ł������B���݂�A1�~���N��A2�~���N�̎��ʕ��@�m�ɂ��邱�Ƃɒ��͂��Ă���A�����̌v��ʂ�ɂ͒������i��ł��Ȃ��B�T���v�����O�͏����ɐi��ł���̂ŁA�y�f�����ɗp���鎎��ɖ�肪����ꍇ�́A�ߔN�����ꂽUHPLC�i��5�j�ɂ�钼�ڎ��ʂ����킹�ĕi������Ɋւ�����𐮂������B
�i��5�j�������q�[�U�J�����𗘗p�������ψ������������t�̃N���}�g�O���t�B�]����HPLC��荂�����������ƕ��͎��Ԃ̒Z�k���\�ɂ��Ă���B
�y�Q�l�����z
1�j �H�i���S�ψ���@�H�i���S�������V�X�e���@�H�i���S�W���ڍׁu2011�N8��15���t�I�[�X�g�����A�E�j���[�W�[�����h�H�i��@�ցiFSANZ�j�AA1�~���N��A2�Ɋւ���t�@�N�g�V�[�g�����\�v
2�j �������_���Ƒ���u2024�N9��19���ta2�~���N�A���������D����3�N�A���������v�v